Questões de Química - Combustão - 2011
Limpar pesquisa
Configurar questões
Tamanho do Texto
Modo escuro
Questão: 6 de 8
129069

Banca: CESPE / Cebraspe
Órgão: CBM/ES
Cargo(s): Oficial Bombeiro Militar Combatente
Ano: 2011
Matéria/Assunto: Química > Termoquímica / Combustão
Das reações químicas, a combustão é a mais comum. Para
que ocorra, é necessário misturar um combustível com um
comburente e fornecer uma energia de ativação, que pode ser chama
aberta, faísca ou centelha elétrica. A combustão de uma quantidade
padrão de determinado material libera uma quantidade de energia
denominada calor de combustão ou poder calorífico. Na tabela a
seguir, apresenta-se o poder calorífico de alguns combustíveis
usuais.
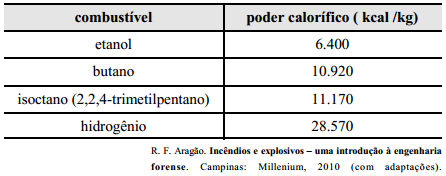
Com base nas informações acima apresentadas, julgue os itens que
se seguem.
que ocorra, é necessário misturar um combustível com um
comburente e fornecer uma energia de ativação, que pode ser chama
aberta, faísca ou centelha elétrica. A combustão de uma quantidade
padrão de determinado material libera uma quantidade de energia
denominada calor de combustão ou poder calorífico. Na tabela a
seguir, apresenta-se o poder calorífico de alguns combustíveis
usuais.

Com base nas informações acima apresentadas, julgue os itens que
se seguem.
Considerando-se que o rendimento da reação completa de
combustão do butano seja de 100%, é correto afirmar que, para
a queima completa de 116 g desse hidrocarboneto, seria
necessária massa mínima de oxigênio superior a 410 g.
Questão: 7 de 8
482870

Banca: CESPE / Cebraspe
Órgão: CBM/DF
Cargo(s): Cadete Bombeiro Militar | --
Ano: 2011
Matéria/Assunto: Química > Termoquímica / Combustão
Nos acidentes automobilísticos, a explosão do tanque de combustível constitui perigo adicional à integridade física do condutor. Em regra, a explosão é causada pelo contato do combustível com faíscas geradas no impacto. A grande quantidade de calor liberada origina-se do processo de queima do combustível.
A título de exemplo, a equação a seguir representa a combustão completa do etanol a 25 ºC e 1 bar.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l) + calor
Com base nessas informações, julgue o item que se segue, considerando que os gases envolvidos na combustão apresentem comportamento ideal; que a constante universal dos gases seja 0,083 barᐧLᐧmol–1ᐧK–1; e que a entalpia padrão de formação do C2H6O(l), a do CO2(g) e a da H2O(l), a 25 ºC, sejam iguais a –278 kJ/mol, –394 kJ/mol e –286 kJ/mol, respectivamente.
A título de exemplo, a equação a seguir representa a combustão completa do etanol a 25 ºC e 1 bar.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l) + calor
Com base nessas informações, julgue o item que se segue, considerando que os gases envolvidos na combustão apresentem comportamento ideal; que a constante universal dos gases seja 0,083 barᐧLᐧmol–1ᐧK–1; e que a entalpia padrão de formação do C2H6O(l), a do CO2(g) e a da H2O(l), a 25 ºC, sejam iguais a –278 kJ/mol, –394 kJ/mol e –286 kJ/mol, respectivamente.
A queima de 1 mol de etanol à pressão de 1 bar e à temperatura de 25 ºC libera mais de 1,0 kJ de calor.
Questão: 8 de 8
482869

Banca: CESPE / Cebraspe
Órgão: CBM/DF
Cargo(s): Cadete Bombeiro Militar | --
Ano: 2011
Matéria/Assunto: Química > Termoquímica / Combustão
Nos acidentes automobilísticos, a explosão do tanque de combustível constitui perigo adicional à integridade física do condutor. Em regra, a explosão é causada pelo contato do combustível com faíscas geradas no impacto. A grande quantidade de calor liberada origina-se do processo de queima do combustível.
A título de exemplo, a equação a seguir representa a combustão completa do etanol a 25 ºC e 1 bar.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l) + calor
Com base nessas informações, julgue o item que se segue, considerando que os gases envolvidos na combustão apresentem comportamento ideal; que a constante universal dos gases seja 0,083 barᐧLᐧmol–1ᐧK–1; e que a entalpia padrão de formação do C2H6O(l), a do CO2(g) e a da H2O(l), a 25 ºC, sejam iguais a –278 kJ/mol, –394 kJ/mol e –286 kJ/mol, respectivamente.
A título de exemplo, a equação a seguir representa a combustão completa do etanol a 25 ºC e 1 bar.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l) + calor
Com base nessas informações, julgue o item que se segue, considerando que os gases envolvidos na combustão apresentem comportamento ideal; que a constante universal dos gases seja 0,083 barᐧLᐧmol–1ᐧK–1; e que a entalpia padrão de formação do C2H6O(l), a do CO2(g) e a da H2O(l), a 25 ºC, sejam iguais a –278 kJ/mol, –394 kJ/mol e –286 kJ/mol, respectivamente.
Na queima de 1 mol de etanol, em determinado local, à pressão de 1 bar e à temperatura de 25 ºC, o calor gerado é superior à variação de energia interna.
