Questões de Fundação Vunesp - Química - Eletrólise
Limpar pesquisa
Questão: 1 de 5
360383

Banca: VUNESP
Órgão: CETESB
Cargo(s): Químico
Ano: 2013
Matéria/Assunto: Química > Eletroquímica / Eletrólise
O estanho é usado no revestimento de embalagens metálicas
de alimentos. Sua obtenção pode ser feita por processo eletrolítico
em soluções aquosas contendo cloreto de estanho (II).
A reação global do processo eletrolítico é
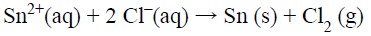
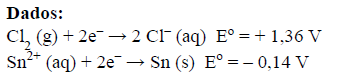
É correto afirmar que, na eletrólise de uma solução aquosa
1,0 mol. L–1 de cloreto de estanho (II) a 25 ºC, o produto formado
no catodo, o potencial teórico aplicado e a polaridade
do anodo são, respectivamente,
Cl2; 1,22 V; positivo.
Cl2; 1,50 V; negativo.
Sn; 1,22 V; positivo.
Sn; 1,50 V; positivo.
Sn; 1,50 V; negativo.
Questão: 2 de 5
359865

Banca: VUNESP
Órgão: DCTA
Cargo(s): Tecnologista - Química
Ano: 2013
Matéria/Assunto: Química > Eletroquímica / Eletrólise
Em uma indústria de galvanoplastia, houve um grande aumento
de demanda. Após a instalação de mais cubas para
eletrodeposição, verificou-se que o tempo total de operação
precisava ser diminuído sem prejudicar a qualidade do
produto final. O operador do banho de decapagem química
(com ácido clorídrico) feita nas peças de aço enviou um relatório
sugerindo algumas medidas para diminuir o tempo
necessário para a decapagem, mantendo-se o processo dentro
dos parâmetros de segurança:
I. Aumento da temperatura do banho de decapagem.
II. Aumento da concentração da solução de ácido clorídrico.
III. Troca do ácido clorídrico por ácido fosfórico.
O responsável técnico pela galvanoplastia analisou as sugestões
e, atribuindo a cada uma das propostas (I, II e III) a classificação
de válida (V) ou inválida (I) para a finalidade de
diminuição do tempo de decapagem; classificou-as, correta
e respectivamente, como
V, I, V.
V, V, I.
I, V, V.
I, I, V.
I, V, I.
Questão: 3 de 5
325036

Banca: VUNESP
Órgão: Pref. São José dos Campos/SP
Cargo(s): Professor - Ciências
Ano: 2019
Matéria/Assunto: Química > Eletroquímica / Eletrólise
A figura seguinte representa o processo de eletrólise empregado na purificação de cobre, no qual por uma solução de sulfato de cobre (CuSO4) passa uma corrente
elétrica que promove uma deposição de 8,50 g de cobre
no cátodo.
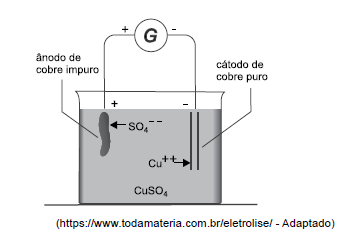
Dados: massas molares Cu=64g; O=16g; S=32g.
Nesse experimento, com base na massa de deposição
de Cobre no cátodo, a massa, em gramas, de sulfato de
cobre (CuSO4) decomposta foi de
2,50.
7,53.
18,82.
21,25.
23,02.
Questão: 4 de 5
156089

Banca: VUNESP
Órgão: PC/SP
Cargo(s): Técnico de Laboratório
Ano: 2014
Matéria/Assunto: Química > Eletroquímica / Eletrólise
O esquema e a equação global representados a seguir referem-se à eletrólise de uma solução aquosa de iodeto de
potássio, na concentração de 0,1 mol/L, usando eletrodos de
grafite.
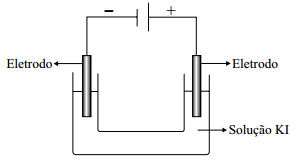
2 H2O (l) + 2I–(aq) → H2( g) + I2 (s) + 2OH–(aq)
Com base nessas informações, afirma-se que na eletrólise de
iodeto de potássio aquoso
há geração de gás hidrogênio no ânodo.
íons iodeto são reduzidos no ânodo.
ocorre redução da água no cátodo.
forma-se iodo no cátodo.
íons de potássio são reduzidos a átomos de potássio.
Questão: 5 de 5
154537

Banca: VUNESP
Órgão: PC/SP
Cargo(s): Perito Criminal
Ano: 2014
Matéria/Assunto: Química > Eletroquímica / Eletrólise
Considerando a constante de Faraday igual a 9,65x104 C.mol–1 e Q = i . t, o tempo, em segundos, necessário para depositar 0,01 mol de cobre sobre um eletrodo de carbono, partindo-se de uma solução contendo íons Cu 2+ (aq) e aplicando-se uma corrente de 0,5 A, é igual a
1 930.
7 365.
5 439.
3 860.
965.
