Questões de Geometria Molecular
Limpar pesquisa
Questão: 1 de 97
299801

Banca: AOCP
Órgão: ITEP/RN
Cargo(s): Perito Criminal - Química
Ano: 2018
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
Octaédrica.
Bipirâmide trigonal.
Trigonal plana.
Piramidal.
Tetraédrica.
Questão: 2 de 97
299811

Banca: AOCP
Órgão: ITEP/RN
Cargo(s): Perito Criminal - Química
Ano: 2018
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
as ligações de nitrogênio.
as interações dipolo-dipolo.
as forças van der Waals.
as ligações covalentes.
as ligações de hidrogênio.
Questão: 3 de 97
295076

Banca: CESPE / Cebraspe
Órgão: PCIEN/PE
Cargo(s): Perito Criminal - Química
Ano: 2016
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
Por apresentarem interações dipolo-dipolo em suas
composições, os compostos AsH3 (MM = 78 g/mol) e
ICl (MM = 162 g/mol) apresentam pontos de fusão próximos.
Em sólidos moleculares, as forças intermoleculares são mais
fortes que as forças intramoleculares.
NaBr e diamante apresentam rede cristalina infinita em sua
estrutura, por isso suas ligações intermoleculares são da mesma
natureza química.
Quando uma substância funde ou entra em ebulição, suas
forças intramoleculares são rompidas.
Quanto mais forte for a ligação hidrogênio, mais enfraquecida
será a ligação covalente entre o hidrogênio e os átomos
F, N e O.
Questão: 4 de 97
78336

Banca: CESPE / Cebraspe
Órgão: PF
Cargo(s): Papiloscopista
Ano: 2012
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
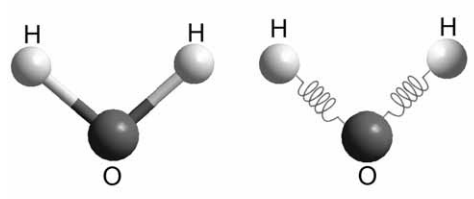
A figura acima ilustra duas representações pictóricas de
ligações químicas em uma molécula de água. Considere o modelo
molecular clássico para uma ligação covalente entre os átomos de
hidrogênio e oxigênio representada por molas via potencial
quadrático do tipo V(r) = ½k(r – r0)2, em que k é a constante elástica
da mola e r0, a distância de equilíbrio. O estiramento máximo ou
amplitude da ligação química O – H é A e mH representa a massa do
hidrogênio. Nesse modelo, assume-se que o oxigênio esteja fixo na
origem do sistema de coordenadas. No instante inicial (t =0), o
átomo de hidrogênio se localiza na posição de estiramento máximo
e, em seguida, é liberado.
Com base na figura e nas informações apresentadas, julgue os itens
seguintes.
que
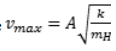 .
.Questão: 5 de 97
78609

Banca: CESPE / Cebraspe
Órgão: PF
Cargo(s): Papiloscopista
Ano: 2012
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares

A figura acima ilustra duas representações pictóricas de
ligações químicas em uma molécula de água. Considere o modelo
molecular clássico para uma ligação covalente entre os átomos de
hidrogênio e oxigênio representada por molas via potencial
quadrático do tipo V(r) = ½k(r – r0)2, em que k é a constante elástica
da mola e r0, a distância de equilíbrio. O estiramento máximo ou
amplitude da ligação química O – H é A e mH representa a massa do
hidrogênio. Nesse modelo, assume-se que o oxigênio esteja fixo na
origem do sistema de coordenadas. No instante inicial (t =0), o
átomo de hidrogênio se localiza na posição de estiramento máximo
e, em seguida, é liberado.
Com base na figura e nas informações apresentadas, julgue os itens
seguintes.
quando em movimento, é inversamente proporcional ao
quadrado da amplitude A.
