Questões de Geometria Molecular
Limpar pesquisa
Questão: 16 de 97
371858

Banca: UFG
Órgão: DEMAE/GO
Cargo(s): Químico
Ano: 2017
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
BF3, CO e NCl3
SO2, CF4 e SF2
BF3, SO2 e CF4
CO, NCl3 e SF2
Questão: 17 de 97
359849

Banca: VUNESP
Órgão: DCTA
Cargo(s): Tecnologista - Química
Ano: 2013
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
NH4+ e CH4.
SF4 e XeF4.
SF4 e CH4.
NH4+, XeF4 e CH4.
NH4+, XeF4 e SF4.
Questão: 18 de 97
350191

Banca: FADESP
Órgão: IF/PA
Cargo(s): Professor - Química
Ano: 2018
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
I, II e IV.
I e IV.
II, III e IV.
I, II e V.
II, IV e V.
Questão: 19 de 97
341375

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
em um equilíbrio químico entre as formas protonada e não
protonada de um par ácido-base conjugados, sendo que cada uma
das formas apresenta uma coloração distinta. Assim, dependendo do
pH, uma ou outra coloração predomina. De forma geral, o
equilíbrio pode ser representado pela equação abaixo, em que A!
representa a forma não protonada.

Por exemplo, o vermelho de metila apresenta coloração
vermelha abaixo do pH 4,4 e amarela acima do pH 6,2. Sua
molécula, na forma protonada, é representada abaixo. Salienta-se
que essa representação, em duas dimensões, não é totalmente, fiel
ao verdadeiro arranjo dos átomos no espaço tridimensional.
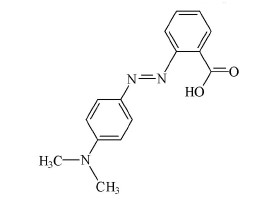
Tendo como referência as informações acima, julgue os itens
conseguintes.
se encontra ligado a dois grupos metila apresenta geometria
trigonal plana.
Questão: 20 de 97
341368

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
sanitizante que pode ser formado in situ pela adição, à água, de
diversas substâncias que contenham cloro. Uma das mais utilizadas
é o Ca(ClO)2 (s), conhecido como pedra de cloro. O Ca(ClO)2 (s), ao
se dissolver, origina ânions ClO- que hidrolisam a água para formar
o HClO, segundo a equação química a seguir.
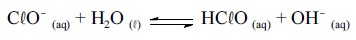
Com base nas informações acima, considerando que todas as
soluções envolvidas apresentem comportamento ideal, que a
atividade da água seja igual à unidade e que as constantes de
autoprotólise da água e de acidez do HClO, à temperatura T, sejam
iguais a 1,0 × 10-14 e 1,0 × 10-8, respectivamente, julgue os itens a seguir.
