Questões de Geometria Molecular
Limpar pesquisa
Questão: 41 de 97
174622

Banca: CESPE / Cebraspe
Órgão: PEFOCE/CE
Cargo(s): Perito Criminal - Química
Ano: 2012
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
receptores de opioides do sistema nervoso central e periférico e do
trato gastrointestinal. Os opioides têm sido muito utilizados no
tratamento paliativo de dores crônicas e intensas de pacientes
terminais de câncer e doenças degenerativas, tais como a artrite
reumatoide. Os alcaloides morfanos, classe química a que pertence
a morfina e seu derivado sintético (heroína), são representantes
conhecidos dos opioides que, além de serem usados no âmbito
médico, têm sido utilizados como drogas ilícitas.
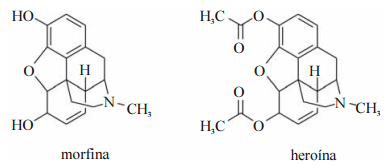
A partir das informações contidas na figura e no texto acima, julgue
os itens subsecutivos.
geometria trigonal plana.
Questão: 42 de 97
174416

Banca: CESPE / Cebraspe
Órgão: PEFOCE/CE
Cargo(s): Perito Criminal - Química
Ano: 2012
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
materiais podem ser explicadas por meio da distribuição eletrônica
dos átomos, da estrutura molecular e das forças intermoleculares
que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos
elementos, julgue os itens subsecutivos.
líquida de metano, fluoreto de metila e álcool metílico são,
respectivamente: forças de dispersão de London, interações
dipolo-dipolo e interações íon-dipolo.
Questão: 43 de 97
174382

Banca: CESPE / Cebraspe
Órgão: PEFOCE/CE
Cargo(s): Perito Criminal - Química
Ano: 2012
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
materiais podem ser explicadas por meio da distribuição eletrônica
dos átomos, da estrutura molecular e das forças intermoleculares
que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos
elementos, julgue os itens subsecutivos.
elementos O, S, Se e Te sejam aproximadamente iguais a 100, -55, -45 e -20, respectivamente. Nesse caso, é correto afirmar que o comportamento anômalo do H2 O nessa série se
deve às forças de dipolo-induzido, que são muito maiores que
as interações presentes nos outros compostos.
Questão: 44 de 97
124292

Banca: CESPE / Cebraspe
Órgão: ANP
Cargo(s): Especialista em Regulação de Petróleo e Derivados, Álcool Combustível e Gás Natural - Área V
Ano: 2013
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
Questão: 45 de 97
113035

Banca: CESPE / Cebraspe
Órgão: CBM/ES
Cargo(s): Policial Militar - Soldado Combatente
Ano: 2011
Matéria/Assunto: Química > Química Geral e Inorgânica / Geometria Molecular, Polaridade e Forças Intermoleculares
livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel
deletério no organismo, por ser capaz de transpor facilmente membranas
celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).
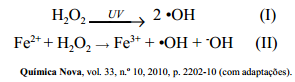
Considerando as informações acima, julgue os itens a seguir.
destaca a característica predominantemente apolar do peróxido de
hidrogênio.
