Questões de Química - Primeiro-Tenente
Limpar pesquisa
Questão: 1 de 12
202447

Banca: CESPE / Cebraspe
Órgão: CBM/CE
Cargo(s): Primeiro-Tenente
Ano: 2014
Matéria/Assunto: Química > Reações Químicas
explosão, seguida de incêndio, em um depósito de fertilizantes à base de NH4 NO3. Devido ao acidente, uma grande quantidade de gases tóxicos foi liberada na atmosfera, expondo a população e os bombeiros que trabalharam no controle do incêndio a riscos de intoxicação. Nesse
sentido, considere que a decomposição do NH4NO3
ocorra por meio da reação abaixo apresentada, que não está balanceada.
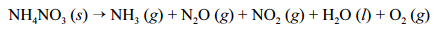
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
Questão: 2 de 12
158777

Banca: CESPE / Cebraspe
Órgão: CBM/CE
Cargo(s): Primeiro-Tenente
Ano: 2014
Matéria/Assunto: Química > Estequiometria / Cálculos químicos
e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
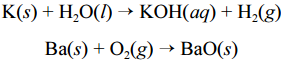
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto
de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Questão: 3 de 12
158785

Banca: CESPE / Cebraspe
Órgão: CBM/CE
Cargo(s): Primeiro-Tenente
Ano: 2014
Matéria/Assunto: Química > Atomística / Modelos atômicos
e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
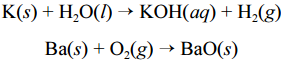
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto
de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Questão: 4 de 12
158824

Banca: CESPE / Cebraspe
Órgão: CBM/CE
Cargo(s): Primeiro-Tenente
Ano: 2014
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
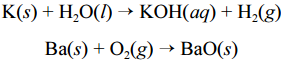
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto
de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Questão: 5 de 12
158825

Banca: CESPE / Cebraspe
Órgão: CBM/CE
Cargo(s): Primeiro-Tenente
Ano: 2014
Matéria/Assunto: Química > Reações Químicas
roupas antichama, como as utilizadas por bombeiros e pilotos
de Fórmula 1, é o polímero Nomex, cuja estrutura é mostrada
abaixo.
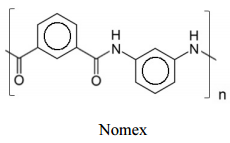
Considere que esse polímero seja formado a partir dos monômeros 1 e 2 abaixo representados, os quais podem ser obtidos a partir do
benzeno, por meio de uma série de reações.
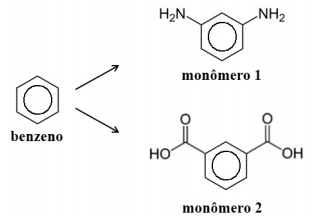
Com base nas informações acima, julgue os próximos itens.
