Questões de Química - Propriedades Periódicas - Professor - Química
Limpar pesquisa
Questão: 1 de 13
407373

Banca: IDECAN
Órgão: IF/PB
Cargo(s): Professor - Química
Ano: 2019
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
reação altamente exotérmica que é uma característica periódica de reatividade dos metais alcalinos e alcalinos terrosos. Explica-se pela tendência a formar cátion às custas da redução do hidrogênio da água que se desprende na forma gasosa.
a Energia de Ionização é definida como a quantidade de energia necessária para fazer com que seja removido um elétron de um elemento na fase líquida, formando um íon, na fase gasosa.
a Energia de Afinidade Eletrônica é definida como a quantidade de energia necessária para fazer com que seja removido um elétron de um íon na fase gasosa, formando um átomo ionizado, também na fase gasosa.
as medidas do Raio Atômico de elementos representativos são de raios covalentes, mostram a tendência relativa decrescente de cada elemento ao longo das famílias em períodos progressivos.
quando a representação da Afinidade Eletrônica é feita com entalpias negativas, tem-se a definição operacional de Afinidade Eletrônica, medindo-se a Energia gasta para se tirar um elétron de um ânion estável e só existe se o íon estável existir.
Questão: 2 de 13
407375

Banca: IDECAN
Órgão: IF/PB
Cargo(s): Professor - Química
Ano: 2019
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
a carga nuclear efetiva é a carga sofrida por um elétron em um átomo polieletrônico. Os elétrons estão presos a eletrosfera, mas são atraídos pelos elétrons que os protegem da carga nuclear, assim, quando aumenta a distância do núcleo, a blindagem (S) aumenta e a carga nuclear (Z*) diminui.
quanto ao raio atômico, em cada coluna (grupo) o número atômico tende a crescer de cima para baixo, isto implica em aumento do número quântico principal (n) dos elétrons do núcleo, e desta forma o átomo aumenta seu tamanho. Em relação ao período, o raio atômico tende a diminuir da esquerda para a direita, seguindo a redução da carga nuclear efetiva (Z* ) à medida que nos movemos ao longo do período.
quanto ao tamanho dos íons ao longo da tabela periódica, os cátions vagam o orbital mais volumoso e são maiores do que os átomos originais e os ânions adicionam elétrons ao orbital mais volumoso e são menores do que os átomos originais.
a energia de ionização diminui à medida que descemos em um grupo, isto porque o elétron mais externo é mais facilmente removido ao descermos em um grupo em camadas mais distantes do núcleo atômico, Ao longo do período, a energia de ionização aumenta o valor da carga nuclear efetiva (Z*) aumenta e, consequentemente, fica mais difícil remover um elétron.
o caráter metálico diminui à medida que descemos em um grupo, aumenta ao longo do período e têm energias de ionização em geral, moderadas a altas.
Questão: 3 de 13
407385

Banca: FUMARC
Órgão: SEDUC/MG
Cargo(s): Professor - Química
Ano: 2018
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
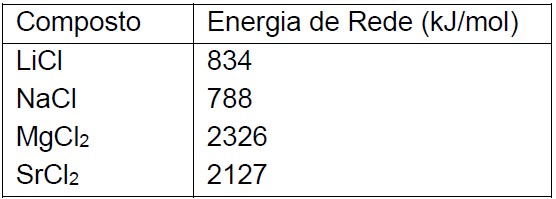
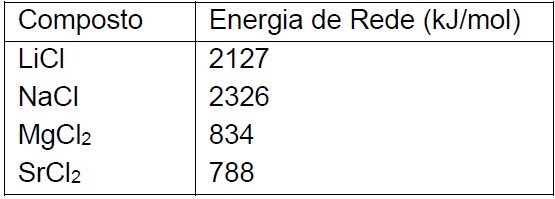
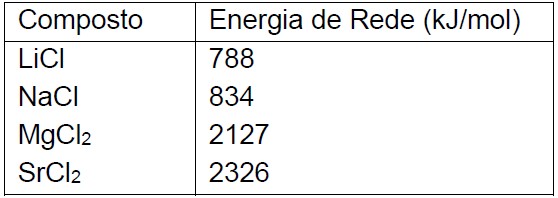
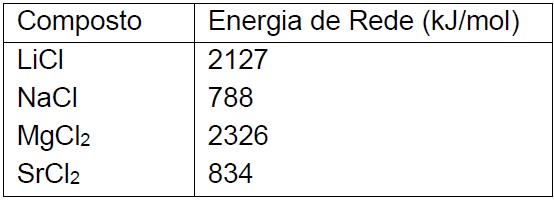
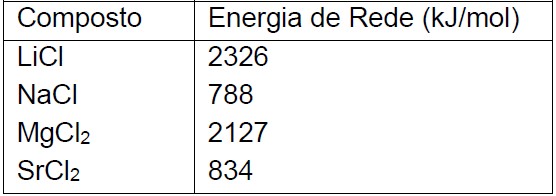
Questão: 4 de 13
352444

Banca: IDECAN
Órgão: IF/Baiano
Cargo(s): Professor - Química
Ano: 2019
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
Em átomos com muitos elétrons, a carga nuclear efetiva (Zef) de um elétron em um orbital p é maior do que o de um elétron em um orbital s da mesma camada.
A maior parte dos metais de transição forma íons com diferentes estados de oxidação, pois os elétrons que se ionizam primeiro são os do subnível p.
O princípio de exclusão de Pauli fundamenta que dois elétrons, no máximo, podem ocupar um dado orbital com o mesmo conjunto de quatro números quânticos.
Na+, F- e Mg2+ são isoeletrônicos, porém seus raios são diferentes, em razão das suas cargas nucleares. Logo, a ordem crescente de raio iônico é: Mg2+< Na+< F-.
Diz-se que um átomo está em um estado excitado quando este absorve um quantum de energia e promove um dos seus elétrons a um nível de energia inferior.
Questão: 5 de 13
350171

Banca: FADESP
Órgão: IF/PA
Cargo(s): Professor - Química
Ano: 2018
Matéria/Assunto: Química > Tabela Periódica / Propriedades Periódicas
número de massa e número de nêutrons no átomo.
número quântico spin.
número quântico principal, n, e a carga nuclear efetiva, Zef.
número quântico principal e número de quântico magnético.
energia de ionização dos átomos.
