Questões de Química - Teorias ácido-base - Professor - Química
Limpar pesquisa
Questão: 1 de 5
333474

Banca: CESPE / Cebraspe
Órgão: SEDUC/CE
Cargo(s): Professor - Química
Ano: 2013
Matéria/Assunto: Química > Química Inorgânica / Teorias ácido-base
Zwiteríons.
Arrhenius.
Lewis.
Pearson.
Brönsted-Lowry.
Questão: 2 de 5
333477

Banca: CESPE / Cebraspe
Órgão: SEDUC/CE
Cargo(s): Professor - Química
Ano: 2013
Matéria/Assunto: Química > Química Inorgânica / Teorias ácido-base
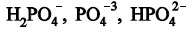
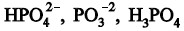

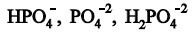
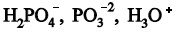
Questão: 3 de 5
341363

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Química Inorgânica / Teorias ácido-base
sanitizante que pode ser formado in situ pela adição, à água, de
diversas substâncias que contenham cloro. Uma das mais utilizadas
é o Ca(ClO)2 (s), conhecido como pedra de cloro. O Ca(ClO)2 (s), ao
se dissolver, origina ânions ClO- que hidrolisam a água para formar
o HClO, segundo a equação química a seguir.
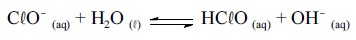
Com base nas informações acima, considerando que todas as
soluções envolvidas apresentem comportamento ideal, que a
atividade da água seja igual à unidade e que as constantes de
autoprotólise da água e de acidez do HClO, à temperatura T, sejam
iguais a 1,0 × 10-14 e 1,0 × 10-8, respectivamente, julgue os itens a seguir.
Questão: 4 de 5
331735

Banca: CESPE / Cebraspe
Órgão: SEDUC/AL
Cargo(s): Professor - Química
Ano: 2013
Matéria/Assunto: Química > Química Inorgânica / Teorias ácido-base
mais abrangente para explicar a teoria ácido-base; segundo esta
teoria, ácido é a espécie doadora de prótons (íons H+) e base é a
espécie receptora de prótons (íons H+).
Considerando essas
informações, julgue os próximos itens.
Questão: 5 de 5
Anulada
602694

Banca: FGV
Órgão: SEDUC/RN
Cargo(s): Professor - Química
Ano: 2025
Gabarito: Oficial
Matéria/Assunto: Química > Química Inorgânica / Teorias ácido-base
I, apenas.
II, apenas.
III e IV, apenas.
I, II e III, apenas.
I, II e IV, apenas.
Questão Anulada
