Questões de Química - Cinética química
Limpar pesquisa
Configurar questões
Tamanho do Texto
Modo escuro
Questão: 46 de 94
347866

Banca: CESPE / Cebraspe
Órgão: FUB
Cargo(s): Químico
Ano: 2011
Matéria/Assunto: Química > Cinética química
Tem-se demonstrado em estudos que a reação de formação
de NH3(g) a partir de H2(g) e N2(g), catalisada pelo ferro e a
temperaturas elevadas, usualmente segue a lei de velocidade
representada por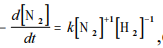 em que k é a constante de
em que k é a constante de
velocidade da reação, t é o tempo de reação, e [N2] e [H2], as
concentrações em quantidade de matéria do N2(g) e do H2(g),respectivamente.
Com relação à reação em apreço e considerando-se condições em
que a lei de velocidade acima apresentada é, de fato, obedecida,
julgue o item seguinte.
de NH3(g) a partir de H2(g) e N2(g), catalisada pelo ferro e a
temperaturas elevadas, usualmente segue a lei de velocidade
representada por
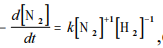 em que k é a constante de
em que k é a constante develocidade da reação, t é o tempo de reação, e [N2] e [H2], as
concentrações em quantidade de matéria do N2(g) e do H2(g),respectivamente.
Com relação à reação em apreço e considerando-se condições em
que a lei de velocidade acima apresentada é, de fato, obedecida,
julgue o item seguinte.
A construção de um gráfico de ln [N2], em função de t, resulta
em uma linha reta.
Questão: 47 de 94
341392

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Cinética química
Para a reação 2 N2O5 (g) → 4 NO2 (g) + O2 (g), verifica-se
experimentalmente que a lei de velocidade é dada
por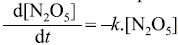 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
experimentalmente que a lei de velocidade é dada
por
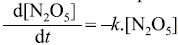 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
A velocidade de formação do NO2, em mol . L-1.s,-1, a 773 K,
no instante 0,10 s, é igual a 0,40 K, em que k representa o valor
absoluto da constante de velocidade, em s-1, na temperatura em
questão.
Questão: 48 de 94
341393

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Cinética química
Para a reação 2 N2O5 (g) → 4 NO2 (g) + O2 (g), verifica-se
experimentalmente que a lei de velocidade é dada
por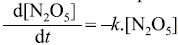 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
experimentalmente que a lei de velocidade é dada
por
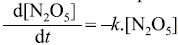 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
O valor da constante de velocidade k , a 773 K, é superior
a 3,0 s-1.
Questão: 49 de 94
341394

Banca: CESPE / Cebraspe
Órgão: SEDUC/AM
Cargo(s): Professor - Química
Ano: 2011
Matéria/Assunto: Química > Cinética química
Para a reação 2 N2O5 (g) → 4 NO2 (g) + O2 (g), verifica-se
experimentalmente que a lei de velocidade é dada
por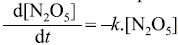 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
experimentalmente que a lei de velocidade é dada
por
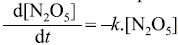 , em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.
, em que representa [N2 O5]concentração do N2O5 e k, a constante de velocidade da reação.Estudos cinéticos, realizados a 773 K, demonstraram que, para uma
concentração inicial de N2O5 igual a 0,20 mol/L, no instante
t = 0,10 s, a concentração do composto havia sido reduzida para
0,14 mol/L.
Tendo como base a reação acima e os gases nela envolvidos e
considerando, ainda, que ln 0,7 = -0,357, julgue os itens seguintes.
Se a reação acontecesse a 600 K, tendo a mesma concentração
inicial de N2O5 (0,20 mol/L), a concentração de N2O5 no tempo
0,10 s seria superior a 0,14 mol/L.
Questão: 50 de 94
335193

Banca: CESPE / Cebraspe
Órgão: FUB
Cargo(s): Químico
Ano: 2015
Matéria/Assunto: Química > Cinética química
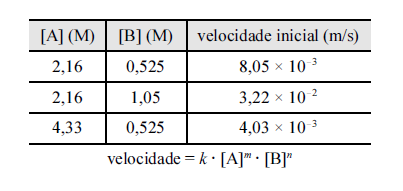
Considerando a reação química geral
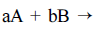 produtos e as
produtos e asvelocidades iniciais, as molaridades e a lei de velocidade mostradas
na tabela acima, julgue os itens subsequentes.
Para a reação de segunda ordem 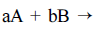 produtos um
gráfico de ln [A] versus o tempo é representado por uma reta.
produtos um
gráfico de ln [A] versus o tempo é representado por uma reta.
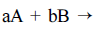 produtos um
gráfico de ln [A] versus o tempo é representado por uma reta.
produtos um
gráfico de ln [A] versus o tempo é representado por uma reta.